Aktuelles
25.09.2023
Klaus Gerwert erhält Innovationspreis des Landes NRW 2023
|
|
Vorstellung des Presiträgers auf der Veranstaltung vom 25.09.2023
© Ministerium für Wirtschaft, Industrie, Klimaschutz und Energie des Landes NRW / Mohr Events GmbH
|
|
|
Bericht auf RTL West vom 26.09.2023
© RTL West
|
|
|
Bericht auf SAT.1 NRW vom 26.09.2023
© SAT.1 NRW
|
21.09.2022
Bericht zum Welt-Alzheimertag 2022
|
|
Bericht zum Welt-Alzheimertag 2022
ARD-Fernsehen, Tagesthemen
|
03.08.2022/21.07.2022
Bochumer Forschende entwickeln Sensor zur Alzheimer-Früherkennung - Studiogespräch: Klaus Gerwert, Biophysiker
|
|
Bochumer Forschende entwickeln Sensor zur Alzheimer-Früherkennung - Studiogespräch: Klaus Gerwert, Biophysiker
WDR-Fernsehen, Aktuelle Stunde, "Lokalzeit Ruhr"
|
Pressemitteilung:
01.06./08.06.2021
Berichte über den von uns entwickelten Alzheimer Sensor im deutschen Fernsehen in den Sendungen "Leschs Kosmos" (ZDF) und "NANO" (3sat).
19.04.2021
Wir gratulieren Julia Stockmann zur bestandenen Promotionsprüfung!
14.10.2019
Pressemitteilung:
28.06.2019
Pressemitteilung:
Link zum Paper:
17.06.2019
Artikel im FOCUS:
03.06.2019
|
|
Eröffnung des Forschungsbaus "ProDi"
WDR-Fernsehen, Aktuelle Stunde, "Lokalzeit Ruhr"
|
Pressemitteilung:
02.05.2019
Pressemitteilung:
Link zum Paper:
29.04.2018
Artikel in der WELT AM SONNTAG:
12.04.2018
Artikel auf ALZFORUM (online):
06.04.2018
Pressemitteilung:
Link zum Paper:
|
|
Innovationspreis Ruhr 2006
Die katalytische Rolle proteingebundener Wassermoleküle
-
Einsichten mit trFTIR
Ein Durchbruch bei der Erforschung der Bausteine des Lebens ist der Forschergruppe um Prof. Dr. Klaus Gerwert (Lehrstuhl für Biophysik) an der Ruhr-Universität Bochum gelungen: Sie konnten das präzise aufeinander abgestimmte Zusammenspiel einzelner Wassermoleküle in der Nanowelt eines Proteins auflösen - mithilfe der von ihnen entwickelten trFTIR (zeitaufgelösten FTIR) Spektroskopie. Damit muss die Rolle des biologischen Wassers für die Proteinfunktion neu bewertet werden. Diese Entwicklung, die international Aufmerksamkeit erregte, wurde im April 2006 mit einem Anerkennungspreis des Innovationspreises Ruhr ausgezeichnet.
Der hier verlinkte Artikel aus Biospektrum 5/2006 (12) 563 gibt eine kurze Zusammenfassung der ausgezeichneten Technik.
|

|
|

Prof. Dr. Klaus Gerwert
Lehrstuhlleiter
|
Mission
Am Lehrstuhl für Biophysik untersuchen wir skalenübergreifend die Proteindynamik. Das Verständnis der Proteindynamik ist dabei nicht nur von akademischem Interesse in der Grundlagenforschung, sondern hat auch ein großes Anwendungspotential in der Medizin. Störungen der Proteindynamik können ernsthafte Erkrankungen auslösen. Praktisch alle Krebs und neurodegenerativen Erkrankungen werden durch onkogene Mutationen oder Fehlfaltungen von Proteinen ausgelöst. Daher eignen sich diese Proteinveränderungen zum einen als Biomarker zur Früherkennung von Krebs oder von neurodegenerativen Erkrankungen. Zum anderen sind die veränderten Proteine "targets" für Wirkstoffe in der Präzisionsmedizin.
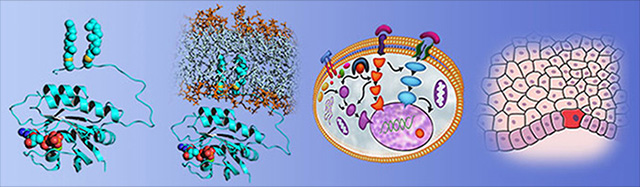
Beispiel Ras-Protein
In der Kopfzeile ist exemplarisch das Ras-Protein auf verschiedenen Skalen gezeigt. Es schaltet externe Wachstumssignale zum Zellkern weiter. Onkogene Mutationen in der GTP-Bindetasche des Ras-Proteins führen zu einer Störung der Abschaltfunktion, so dass Ras permanent die Wachstumssignalkette anregt und unkontrollierte Wachstumssignale im Zellkern induziert. Die permanente Aktivierung der Wachstumssignalwege führt schließlich zu einem unkontrollierten Zellwachstum, so dass sich langfristig Tumoren im Zellverband, dem Gewebe, ausbilden. In allen Tumorgeweben findet man mehr oder weniger onkogen mutiertes Ras-Protein.
Methodischer Ansatz
Zur Untersuchung der Proteindynamik auf atomarer Ebene wird eine breite Palette von biochemischen und molekularbiologischen Methoden mit molekular-auflösenden biophysikalischen Methoden orchestriert. Insbesondere werden dabei von uns neu entwickelte Methoden der Label-freien zeitaufgelösten Infrarot-Differenzspektroskopie an rekombinanten Proteinen eingesetzt. Die experimentellen Ergebnisse werden mit biomolekularen Simulationen ausgewertet. Dieser Ansatz liefert schließlich molekulare Reaktionsmechanismen von Proteinen mit höchster räumlicher und zeitlicher Auflösung. Es werden nicht nur statische Bilder des Protein-Grundzustands, sondern Filme von der Proteinfunktion erstellt. Mit diesem Ansatz konnte z. B. der molekulare Reaktionsmechanismus des Bakteriorhodopsins und des Ras-Proteins aufgeklärt werden.
Weiterhin werden mit der ATR-Technik (Körper)-Flüssigkeiten vermessen. Insbesondere werden Fehlfaltungen von Proteinbiomarkern bestimmt, die an der funktionalisierten Oberfläche des ATR-Kristalls gebunden werden. Auf ATR-Technik basierend wurde z. B. ein Immunosensor für die Alzheimer-Früherkennung in Blutproben entwickelt.
Lebende Zellen werden mit Hilfe von Raman- und CARS-Imaging Label-frei analysiert. Insbesondere wird die Wirkung von Medikamenten (Companion diagnostics) auf die Zellfunktion mit räumlicher Verteilung der Wirkstoffe dargestellt.
Gewebe wird mit Hilfe von FTIR-Imaging Label-frei klassifiziert. Insbesondere wird Tumorgewebe automatisiert und Label-frei differential diagnostisch charakterisiert. Durch Kombination mit molekularauflösender Proteom-Analyse können schließlich Protein-Biomarker identifiziert werden.
Drittmittelfinanzierung und Kooperationspartner
Die Arbeiten werden weit überwiegend über Drittmittel (DFG, BMBF, EU) finanziert und hauptsächlich im Rahmen von großen Konsortien durchgeführt. Die grundlagenwissenschaftlich ausgerichteten Arbeiten werden im SFB 642 (Sprecher K. Gerwert) und die translational und klinisch ausgerichteten Arbeiten im Rahmen von PURE (Sprecher K. Gerwert) durchgeführt. Der Lehrstuhl hat nationale und internationale Kooperationspartner, insbesondere das ISAS und das Max-Planck-Institut für molekulare Physiologie in Dortmund sowie das SIBS in Shanghai.
Zurück zur Biophysik-Startseite





